polare und unpolare Atombindungen unterscheiden, Elektronegativität einfach erklärt YouTube

Grundwissen. Elektronegativität und polare Elektronenpaarbindungen. Das Wichtigste auf einen Blick. Die Elektronegativität bezeichnet die Fähigkeit eines Atoms die Elektronen einer Bindung anzuziehen. Die Elektronegativität wird durch die Kernladung und den Atomradius maßgeblich bestimmt.
Wann ist ein Molekül ein Dipol Molekül? Dipole polare Atombindung Elektronegativität YouTube
von 35. Download als PDF. Download als Word. Zusatzmaterialien als ZIP. Elektronegativität unpolarer und polarer Atombindungen. Die Elektronegativität ist ein wichtiges Denkmodell für das Verständnis der Unterscheidung von polaren und unpolaren Elektronenpaarbindungen.
Tabel Elektronegativitas
Die häufig zitierte Faustregel, dass bis zu einer bestimmten Elektronegativitätsdifferenz ( Delta-EN) von etwa 0,4 eine kovalente Bindung und ab ca. 1,7 eine ionische Bindung vorliegt, sollte eher so verstanden werden, dass es in diesen Fällen sinnvoll ist, die Bindung eher kovalent oder eher ionisch zu beschreiben.
Elektronegativität wichtiger Hauptgruppenelemente DocCheck
Wie unterscheidet man ob eine Bindung polar oder unpolar ist? Was ist die Elektronegativität? Was hat sie damit zu tun? Wie berechnet man die Elektronegativitätsdifferenz und was bringt sie einem? Wie kann man dadurch unpolare, polare kovalente Bindungen und Ionische Bindungen unterscheiden?
Elektronegativität lernen mit Serlo!
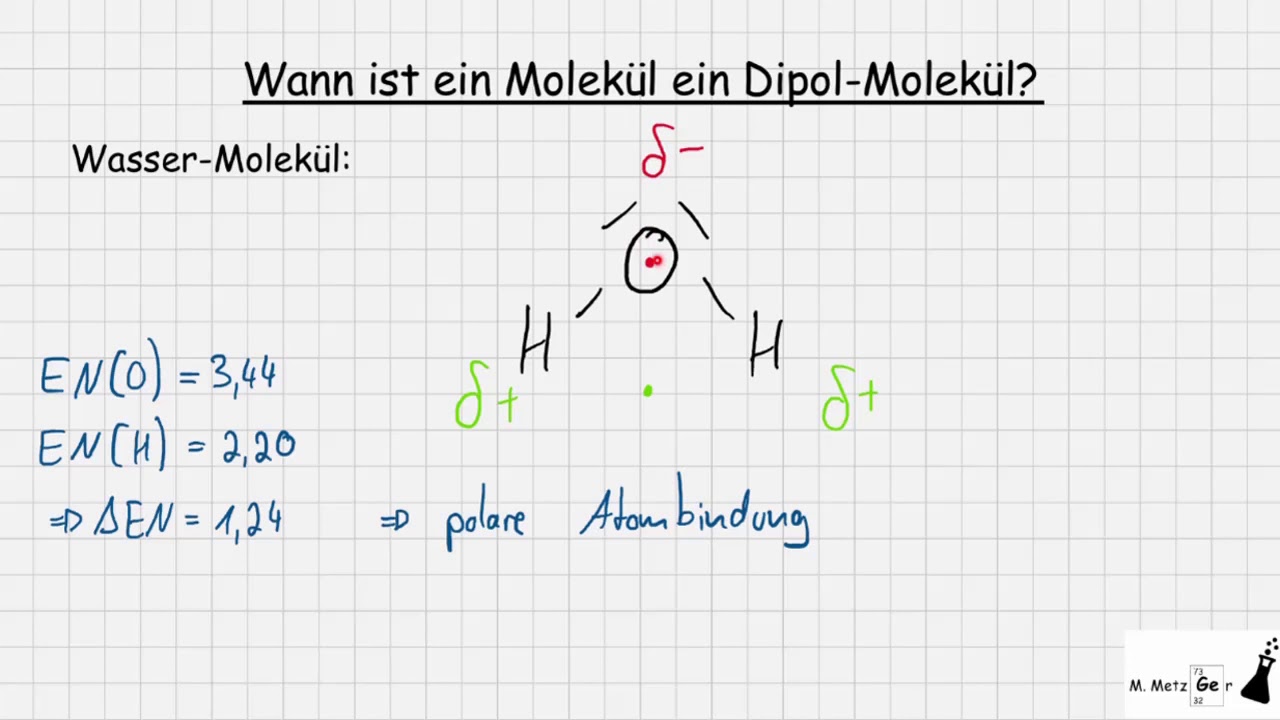
Ein Stoff ist dann polar, wenn seine Moleküle eine ungleiche Aufteilung der Elektronegativität aufweisen. Das heißt, dass die Elektronen stärker auf ein Atom als auf das andere gerichtet sind. Dadurch entsteht an einem Ende des Moleküls eine negative Ladung und am anderen Ende eine positive Ladung.
Atombindungen • Erklärung, Eigenschaften · [mit Video]
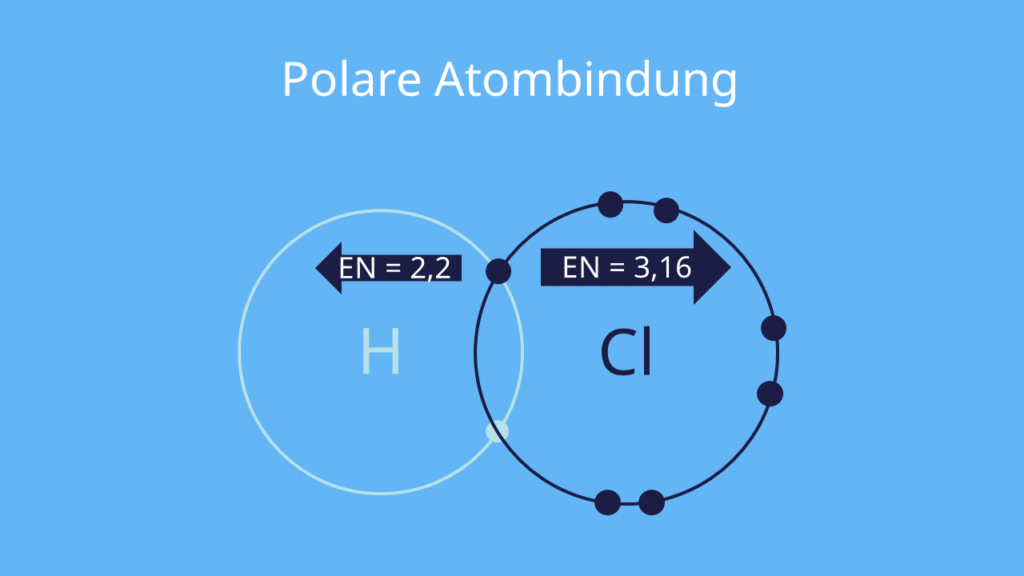
Chemische Größe. Elektronegativität (Abkürzung EN; Formelzeichen χ (gr.: Chi)) ist ein relatives Maß für die Fähigkeit eines Atoms, in einer chemischen Bindung Elektronenpaare an sich zu ziehen ( Linus Pauling ). [1] .
Elektronegativität
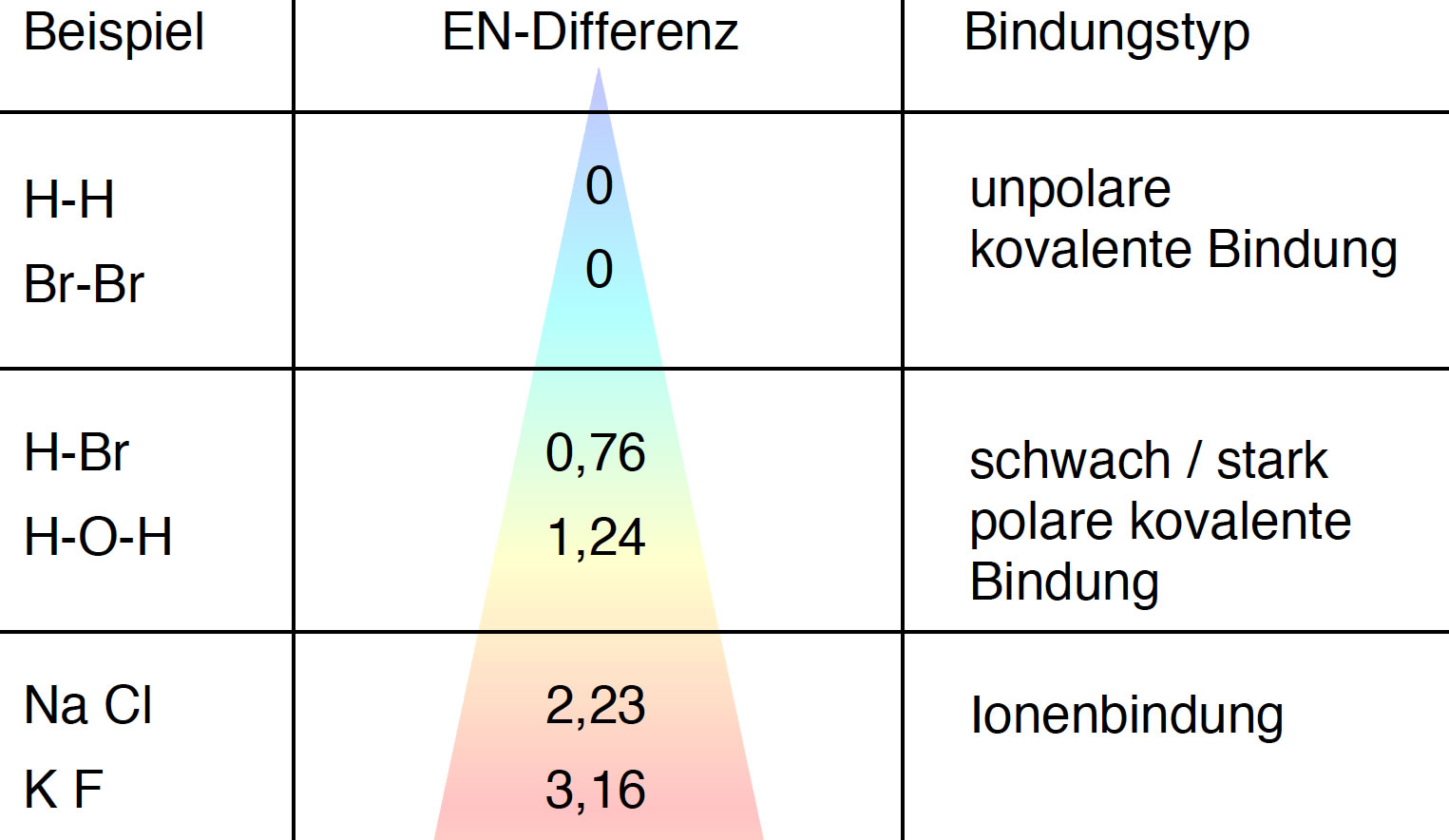
Die häufig zitierte Faustregel, dass bis zu einer bestimmten Elektronegativitätsdifferenz ( Delta-EN) von etwa 0,4 eine kovalente Bindung und ab ca. 1,7 eine ionische Bindung vorliegt, sollte eher so verstanden werden, dass es in diesen Fällen sinnvoll ist, die Bindung eher kovalent oder eher ionisch zu beschreiben.
Polarität • polar und unpolar, Polarität Chemie · [mit Video]

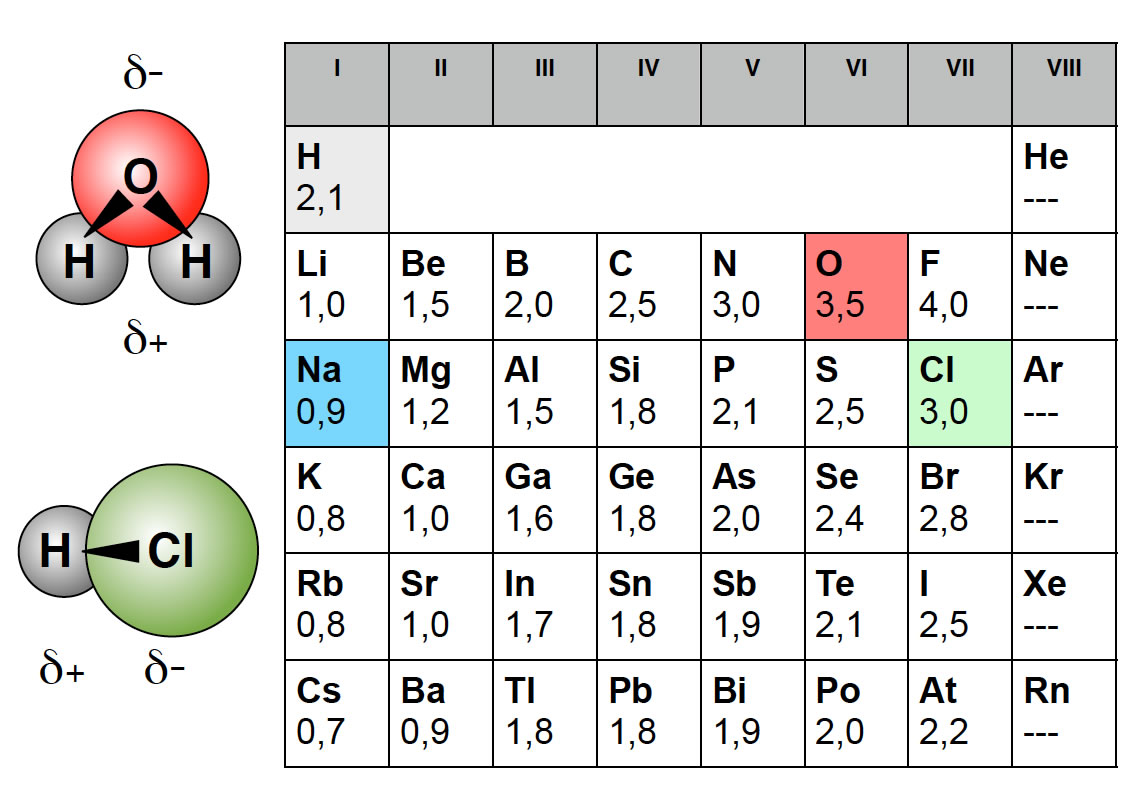
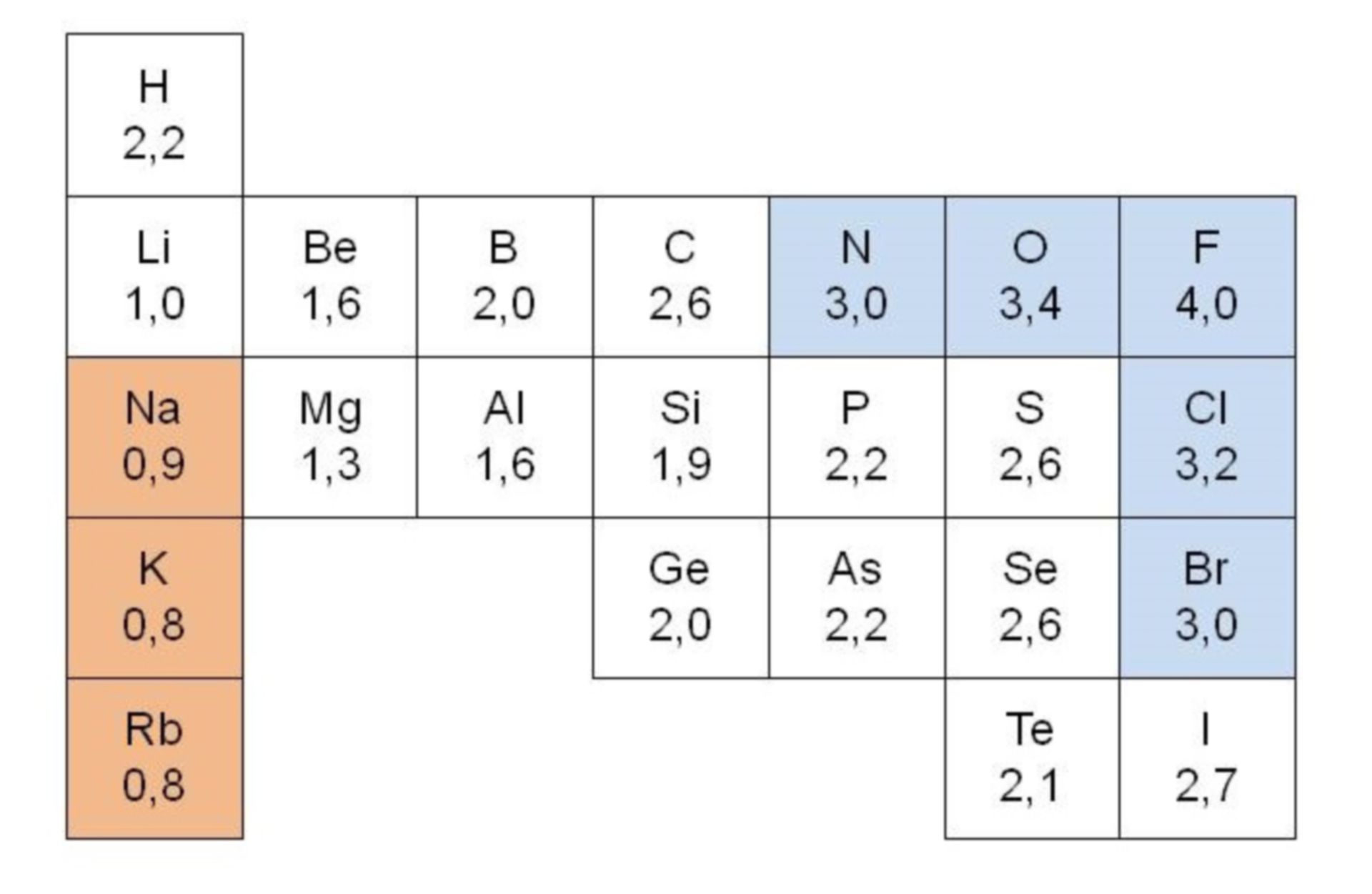
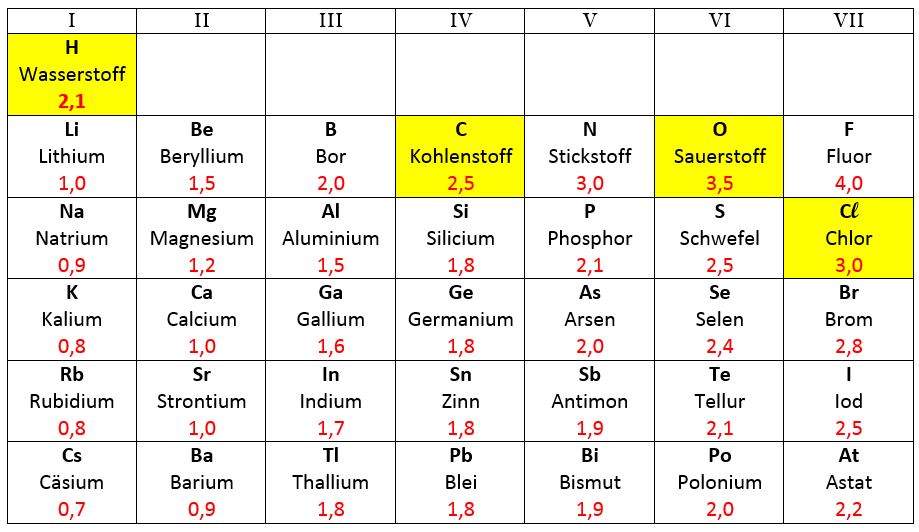
Die Elektronegativität (abgekürzt: EN) ist ein relatives Maß dafür, wie stark ein Atom die Elektronen in einer chemischen Bindung zu sich ziehen kann (Pauling). Ihr Formelzeichen lautet χ (griech.: Chi). Im Periodensystem findest du bei den meisten Elementen einen Wert für die Elektronegativität.
Polarität • polar und unpolar, Polarität Chemie · [mit Video]

Polarität bezeichnet in der Chemie die Bildung getrennter Ladungs schwerpunkte in Atomgruppen aufgrund von Ladungsverschiebungen; dadurch sind die Atomgruppen nicht mehr elektrisch neutral. Das elektrische Dipolmoment ist ein Maß für die Polarität eines Moleküls und bestimmt die Löslichkeit eines Stoffs oder seine Fähigkeit.
Polarität • polar und unpolar, Polarität Chemie · [mit Video]

Einzelne Bindungen in polaren Molekülen haben eine Elektronegativitätsdifferenz ( EN) zwischen 0,5 und 1,7. Die resultierende Bindung kannst du als polare Atombindung bezeichnen. Bei einem sehr hohen EN (>1,7) sprichst du von einer Ionenbindung. Dadurch entstehen zwei Ionen, die grundsätzlich polar sind.
Polare Bindungen
Elektonegativitäten nach Pauling: Nehmen wir das Beispiel: Natriumchlorid. EN Na: 0,82. EN Cl : 3,16. Die EN =2,34 und liegt höher als der Grenzwert ( EN> 1,7) Folglich handelt es sich bei Natriumchlorid um eine Ionenbindung. Summenformel. Strukturformel.
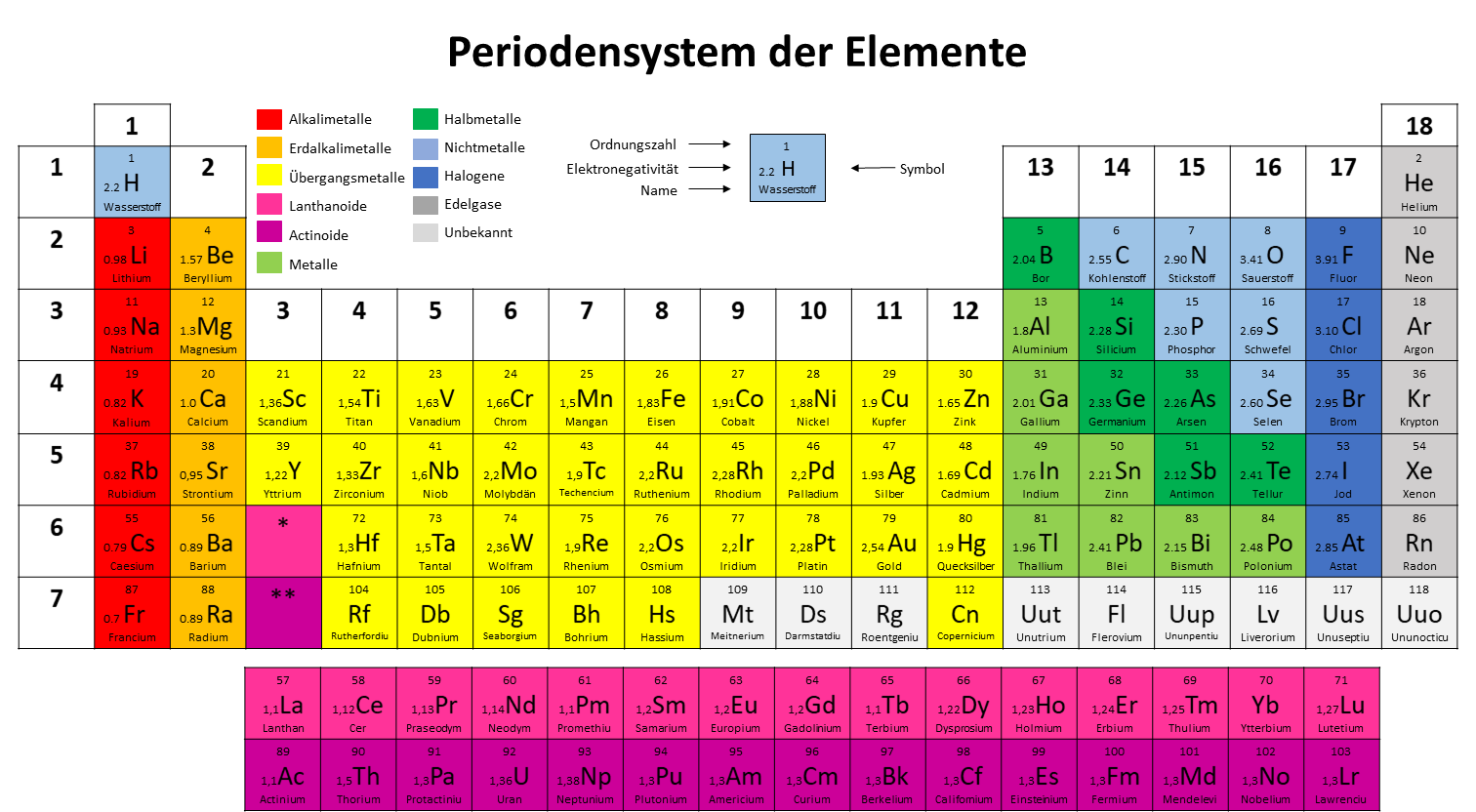
Periodensystem Zum Ausdrucken
Wann ist ein Molekül polar? Ändern Sie die Elektronegativität der Atome eines Molekül und beobachten Sie die Auswirkung auf die Polarität. Wie verhält sich ein polares Molekül in einem elektrischen Feld? Wie beeinflussen die Bindungswinkel die Polarität.
Kovalente Bindung • Polare Atombindung, Bindungsarten · [mit Video]
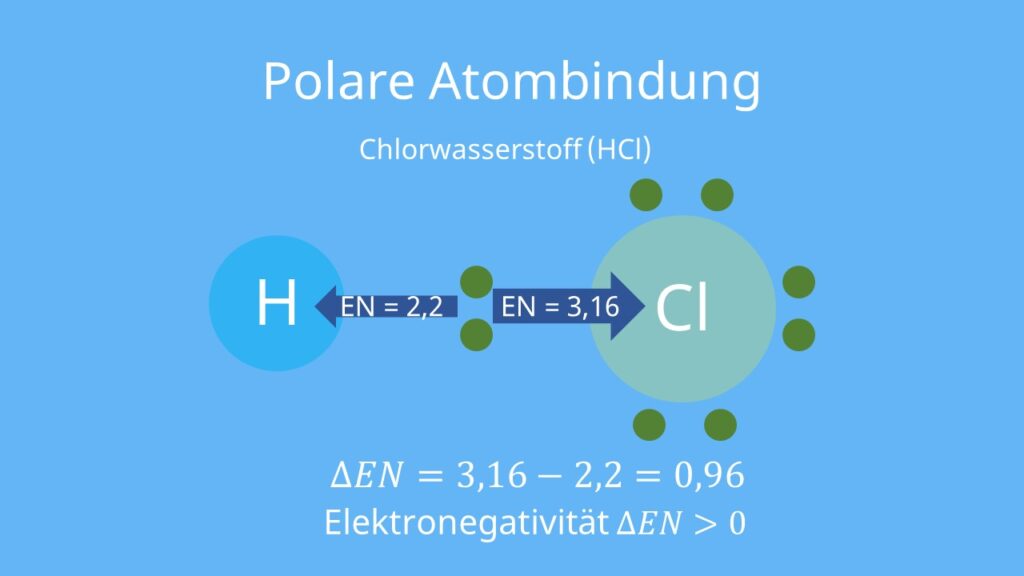
Inhaltsübersicht. Elektronegativität. Die Elektronegativität (kurz EN) gibt an, wie stark die Bindungselektronen in einer Verbindung zu einem der Bindungspartner gezogen werden. Erklärung der Elektronegativität. An einer Verbindung, zum Beispiel in einem Molekül, sind immer mehrere Partner beteiligt. Diese teilen sich Elektronen.
Elektronegativität • Erklärung, Periodensystem, Tabelle · [mit Video]

Stoffe sind polar, wenn sie ein asymmetrisches Molekül bilden, das Molekül muss also eine ungleiche Verteilung von negativen und positiven Ladungen haben. Dies kann passieren, wenn das Molekül eine ungleiche Anzahl an Elektronen hat, oder wenn verschiedene Atome unterschiedliche Elektronegativität haben.
nh3 polaire ou apolaire

Wie stark die Bindungselektronen in Richtung eines Atoms verschoben sind, lässt sich durch die Bildung der Differenz der beiden EN-Werte bestimmen (größerer Wert - kleinerer Wert). Dabei gelten folgende Richtwerte: Δ EN < 0,5 : unpolare Bindung. Δ EN ≥ 0,5 : polare Bindung.
Unterrichtsmaterial Chemie Die Elektronegativität

erstmal kann nicht jeder stoff Polar sein, nur Moleküle. Wenn der Elektronegativitätswert 0,5 < En Molek. < 1,7 ist. 6 Kommentare. jobul. Topnutzer. im Thema Chemie. 08.12.2011, 19:27. Du meinst O=C=O Kohlendioxid. Die C=O Bindungen sind ein wenig polar, das Gesamtmolekül aber nicht, denn beide Enden sind gleich.
.

